0049 821 50 87 53 0
0043 6217 507 22
Montag-Donnerstag: 07.00-16.00 Uhr
Freitag: 07.00-14.00 Uhr
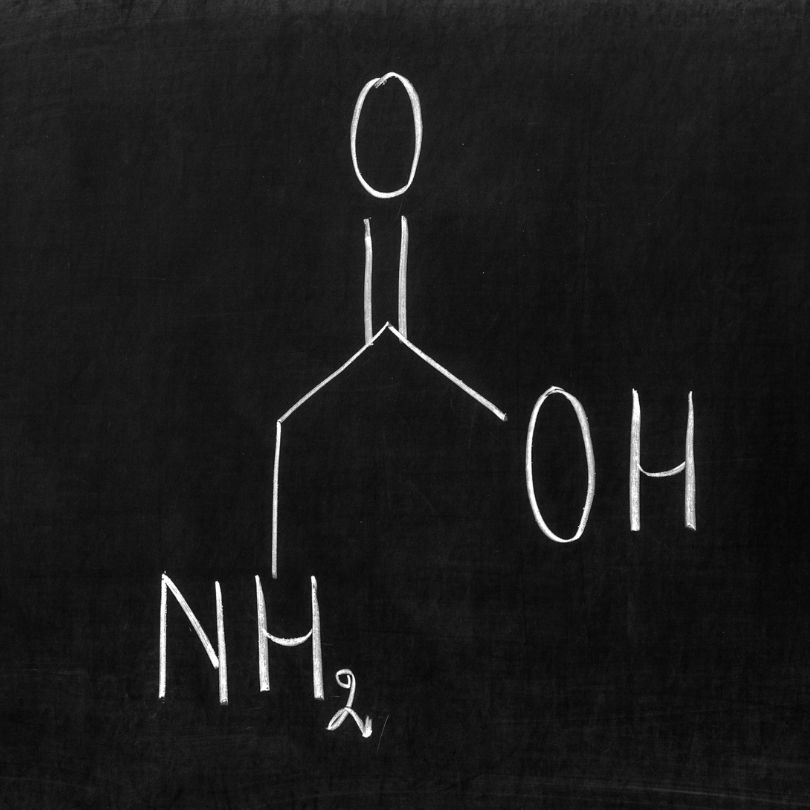
1) First things first – Proteinbiosynthese
Als proteinogene Aminosäure ist Glycin Bestandteil zahlreicher Proteine und Enzyme. Eine besondere Bedeutung kommt Glycin hier als Hauptbestandteil der Strukturproteine Kollagen und Elastin zu (>30%). Im Falle von Kollagen ist mindestens jede dritte Aminosäure ein Glycinmolekül.
Durch den hohen Anteil in 28 verschiedenen Kollagentypen in unseren Geweben ist Glycin damit auch eine der häufigsten Aminosäuren in unserem Körper (>11%). Glycin ermöglicht durch seine geringe Größe erst die Anordnung von Kollagen in der typischen Fibrillen-Struktur und ist somit essentiell für die Funktionalität unseres Bindegewebes. Entsprechend hoch fällt der Anteil des Glycins aus (Eigensynthese + Ernährung), der für die Kollagen-Synthese benötigt wird (ca. 80%). Aus dieser Perspektive ist leicht vorstellbar, welche Folgen ein Glycin-Defizit für Körperstrukturen hat, die auf eine Integrität des Bindegewebes angewiesen sind – und das sind die meisten. Besonders wichtig ist die Bindegewebeintegrität für Knochen & Knorpel, Blutgefäße, Zahnfleisch & Zähne sowie der Haut [Meléndez-Hevia et al., 2009; Wang et al., 2013].
2) Vorstufenfunktion
Neben seiner wichtigen Rolle beim Aufbau von Strukturproteinen dient Glycin auch als Vorstufe vieler wichtiger niedermolekularer Stoffwechselprodukte. Dazu gehören:
[Holeček M et al., 2025; Wang et al., 2013]
3) Vorstufenfunktion
Wie bereits erwähnt, dient Glutathion unter anderem der Biotransformation in unserer Leber (Detoxifikation). Dort wird Glutathion an Substanzen gebunden, um diese sowohl unschädlich(er) als auch löslicher zu machen. Auf diese Weise können zuvor schwer lösliche Verbindungen besser ausgeschieden werden. Glycin dient aber nicht nur als Glutathion-Vorstufe, sondern wird auch selbst für den Konjugationsprozess in der Leber verwendet – Glycin trägt also doppelt zur Biotransformation in der Leber bei [Holeček M et al., 2025].
4) Glycin als Neurotransmitter
Glycin kommen weitere wichtige Funktionen innerhalb des Nervensystems zu. So ist Glycin selbst ein inhibitorischer Neurotransmitter und hat zudem eine Funktion im Rahmen der Signaltransduktion des exzitatorischen Neurotransmitters Glutamat. Auf die Feinheiten sowie das Potential der Aminosäure zur Steigerung der Schlafqualität gehen wir in einem der nächsten Blogartikel ein [Holeček M et al., 2025; Bowery & Smart, 2006].
Als nicht essentielle Aminosäure kann unser Körper Glycin auch selbst bilden. Dies geschieht entweder aus L-Serin oder L-Threonin. Auch über den Abbau von Hyrdoxyprolin kann Glycin gewonnen werden. Trotz dieser Bildungswege gilt die Aminosäure als bedingt essentiell – d.h. situativ reicht die Eigenproduktion oftmals nicht aus (Verletzungen, Krankheit, Regeneration, Wachstum …). In der verfügbaren Literatur zu Glycin wird sogar beschrieben, dass die körpereigene Bildungskapazität von Glycin selbst ohne situativen Mehrbedarf (Verletzungen…) nicht wirklich ausreicht, um den metabolischen Bedarf zu decken. Ein gewisser Anteil muss also ohnehin über die Ernährung gedeckt werden. Eine Quantifizierung dieses metabolischen Defizits, über das man in der Literatur mehrfach stolpert, sind etwa 5g. Glycin wird daher trotz seiner offiziellen Einstufung als nicht-essentiell in diversen Studien als limitierender Baustein beschrieben. Wird das metabolische Glycin-Defizit nicht geschlossen, kann Glycin so zum Bottleneck für die Synthese von Kollagen, Glutathion oder sogar Hämoglobin werden [Meléndez-Hevia et al., 2009; Garcia-Santos et al., 2017; McCarty et al., 2018].
Holeček M. Glycine as a conditionally essential amino acid and its relationship to l-serine. Metabolism. 2025 Sep;170:156330. doi: 10.1016/j.metabol.2025.156330. Epub 2025 Jun 15. PMID: 40527450. https://doi.org/10.1016/j.metabol.2025.156330
Meléndez-Hevia E, De Paz-Lugo P, Cornish-Bowden A, Cárdenas ML. A weak link in metabolism: the metabolic capacity for glycine biosynthesis does not satisfy the need for collagen synthesis. J Biosci. 2009 Dec;34(6):853-72. doi: 10.1007/s12038-009-0100-9. PMID: 20093739. https://doi.org/10.1007/s12038-009-0100-9
Wang W, Wu Z, Dai Z, Yang Y, Wang J, Wu G. Glycine metabolism in animals and humans: implications for nutrition and health. Amino Acids. 2013 Sep;45(3):463-77. doi: 10.1007/s00726-013-1493-1. Epub 2013 Apr 25. PMID: 23615880. https://doi.org/10.1007/s00726-013-1493-1
Bowery NG, Smart TG. GABA and glycine as neurotransmitters: a brief history. Br J Pharmacol. 2006 Jan;147 Suppl 1(Suppl 1):S109-19. doi: 10.1038/sj.bjp.0706443. PMID: 16402094; PMCID: PMC1760744. https://doi.org/10.1038/sj.bjp.0706443
Garcia-Santos D, Schranzhofer M, Bergeron R, Sheftel AD, Ponka P. Extracellular glycine is necessary for optimal hemoglobinization of erythroid cells. Haematologica. 2017 Aug;102(8):1314-1323. doi: 10.3324/haematol.2016.155671. Epub 2017 May 11. PMID: 28495915; PMCID: PMC5541866. https://doi.org/10.3324/haematol.2016.155671
McCarty MF, O’Keefe JH, DiNicolantonio JJ. Dietary Glycine Is Rate-Limiting for Glutathione Synthesis and May Have Broad Potential for Health Protection. Ochsner J. 2018 Spring;18(1):81-87. PMID: 29559876; PMCID: PMC5855430. https://www.ochsnerjournal.org/content/18/1/81/tab-article-info
Sie sehen gerade einen Platzhalterinhalt von Vimeo. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenSie sehen gerade einen Platzhalterinhalt von YouTube. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf die Schaltfläche unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Mehr InformationenSie müssen den Inhalt von reCAPTCHA laden, um das Formular abzuschicken. Bitte beachten Sie, dass dabei Daten mit Drittanbietern ausgetauscht werden.
Mehr Informationen